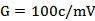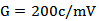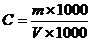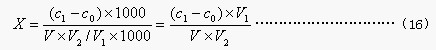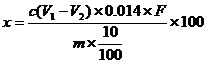1.试样的制备(GB/T4928-2008)
方法提要:在保证样品有代表性,不损失或少损失酒精的前提下,用振摇、超声波或搅拌等方式除去酒样中的二氧化碳气体。
(1)**法
将恒温**15℃~20℃的酒样300mL倒入1000mL锥形瓶中,盖塞(橡皮塞),在恒温室内,轻轻摇动、开塞放气(开始有“砰砰”声),盖塞。反复操作,直**无气体逸出为止。用单层中速干滤纸(漏斗上面盖表面玻璃)过滤。
(2)第二法
采用超声波或磁力搅拌法除气,将恒温**15℃~20℃的酒样300mL移入带排气塞的瓶中,置于声波水槽中(或磁力器上),超声(或搅拌)一定时间后,用单层中速干滤纸过滤(漏斗上面盖表面玻璃)。
注:要通过与**法比对,使其酒精度测定结果相似,以确定超声(或搅拌)时间和温度
(3)试样的保存
将除气后的酒样收集于据赛锥形瓶中,温度保存在15℃~20℃,密封保存,限制在2h内使用。
啤酒试样的制备((GB/T4928-1991)
原理:用反复注流等方式除去啤酒中的二氧化碳,以消除其在理化分析中的影响。
样品制备:
方法一
取预先在冰箱中冷**10-15℃的啤酒500-700mL于清洁、干燥的1OOOmL搪瓷杯中,以细流注入同样体积的另一搪瓷杯中,注人时两搪瓷杯之间距离约20-30cm。反复注流50次(一个反复为一次),以充分除去酒中二氧化碳,静置。
方法二
取预先在冰箱中冷**10-15℃的啤酒,启盖后经快速滤纸过滤**三角烧瓶中,稍加振摇,静置,以充分除去酒中的二氧化碳。
样品保存
除气后的啤酒,用表面玻璃盖住,其温度应保持在15-20℃左右备用。
啤酒除气操作时的室温应不超过250℃。
2.啤酒中色度的测定
原理:将除气后的酒样注入EBC比色计〔或SD
色度仪)的比色皿中,与标准色盘比较,确定酒样的色度。
仪器:EBC比色计(或SD
色度仪)。
试剂和溶液:哈同(Hartong)基准溶液:称取重铬酸钾(K
2Cr
2O
7)0.1g(精确**0.001g)和亚硝酰铁氰化钠{Na
2[Fe(CN)
5NO) ]}·2H
2O}3.5g(精确**0.001g),用水溶解并定容**1 OOOmL,贮于棕色瓶中,于暗处放置24h后使用。
分析步骤:
(1)仪器的校正:将Hartong溶液注入40mm比色皿,用
色度计测定。其标准色度应为15EBC单位;若使用25mm比色皿,其标准读数为9.4EBC。仪器的校正应每周一次。
(2)将已制备好的酒样(否则需滤纸过滤)注入25mm比色皿中,然后放到比色盒中,与标准
色盘进行比较,当两者色调一致时,即可直接读数为结果。
(3)计算
如使用其他规格的比色皿,则需要换成25mm比色皿的数据为其结果换算式如下
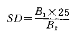
式中:SD— 样品的色度,EBC单位;
B
1— 实测色度,EBC单位;
B
2— 使用比色皿厚度,mm;
25— 换算系数,mm。
3.啤酒中浊度的测定
原理:EBC
浊度计是利用光学原理测定啤酒由于老化或受冷而引起的混浊。其测量是利用富尔马肼(Formazin)标准浊度液校正
浊度计,直接测定啤酒样品的浊度,以浊度单位EBC表示。
仪器:浊度测定仪、0.2mm滤膜、烧瓶、100ml容量瓶
试剂:(1)无浊度水:将蒸馏水通过0.2mm滤膜过滤,收集于用滤过水荡洗两次的烧瓶中。
(2)浊度贮备液
① 硫酸肼溶液(10g/L):称取1.000g硫酸肼((NH
2)
2SO
4·H
2SO
4)溶于水中,定容**100ml。静置4h使其完全溶解。
② 六次甲基四胺溶液(100g/L):称取10.00g六次甲基四胺((CH
2)
6N
4)溶于水中,定容**100ml。
③ 富尔马肼标准溶储备液:吸取25.00ml硫酸肼溶液于一个具塞锥形配中,边搅拌边用吸管加入25.00ml六次甲基四胺溶液,摇匀。于室温下静置反应24h后使用。此溶液浊度为1000EBC单位,在二个月内可保持稳定。
④富尔马肼标准溶使用液:分别吸取富尔马肼标准溶储备液0 ml、0.20ml、0.50 ml、1.00 ml于4个1000ml容量瓶中,加蒸馏水稀释**刻度,摇匀。该标准浊度使用液的浊度分别为0EBC、0。2EBC、0.5EBC、1.0EBC。该溶液应当当天配制当天使用。
测定:(1)开启仪器背后右下角电源开关(2)将除气但未经过滤,温度在20±0.1℃的试样倒入试样瓶内到刻度线,盖紧瓶盖,用不落毛软布擦净试样瓶上的水迹和指印(3)将装好待测溶液的试样瓶,置入试样座内,并保证试样瓶的刻度线应对准试样座上的白色定位线,然后盖上遮光盖(4)稍等片刻(约1~2秒)按测量键仪器进入测量状态,在快速模式约4秒,平均模式约13秒仪器显示测量结果。
4.生熟啤酒的鉴别
原理:不经巴氏灭菌或瞬时高温灭菌的啤酒,酒体中各种酶系仍保持着活性。其中的蔗糖转化酶可以将蔗糖分解为葡萄糖,利用葡萄糖鉴别试纸可以检查酒体中的蔗糖转化酶活性。
仪器:(1)移液管 ;(2)试管 ;(3)恒温水浴:控温精度±0.5℃ #p#分页标题#e#
试剂和溶液:(1)250g/L蔗糖溶液:称取蔗糖25g,用水溶解并定容**100mL;
(2)葡萄糖鉴别试纸(或尿糖试纸)
分析步骤:分别吸取酒样10mL于三支试管中。于**支试管(A)中加水2.0mL,摇匀。将第二支试管(B)放入沸水浴中加热2min,取出冷却。于第二和第三支试管(C)中各加蔗糖溶液2.0mL,摇匀,然后将三支试管同时置于(30±0.5)℃水浴中保温30min 。随后将三支试管再同时置于沸水中加热2min ,取出,冷却**室温。分别用葡萄糖鉴别试纸的一端浸入各试管中30~60秒,取出,立即观察其颜色变化,记录结果。
判定:若C管试纸变色且颜色深于A管和B管(呈阳性),判为生啤酒或鲜啤酒。若不变色或者与A管和B管颜色无差别,则判为熟啤酒。
注:(1)250g/L蔗糖溶液应用分析纯蔗糖,配制完成后,先用葡萄糖鉴别试纸检测蔗糖溶液的纯度。否则重新配制
(2)用葡萄糖溶液检测试纸是否过期
啤酒中双乙酰含量的测定
联二酮:系指双乙酰和2.3-戊二酮的总称
双乙酰:2.3一丁二酮。
双乙酰是**主要的生青味物质,其含量越高,会导致啤酒口味不纯,有甜味直**馊饭味,在啤酒中味觉值根据啤酒的种类和品种的不同而不同。
淡色酒下面发酵酒 一般为0.1—0.2ppm
上面发酵酒 一般为0.1—0.4ppm
2.3一戊二酮,在啤酒中的味觉值约为0.6-0.9ppm,一般对啤酒口味的影响不大,且在正常啤酒中双乙酰和2.3一戊二酮之比约3-6:1
联二酮在啤酒中 的 标准值为〈0.1mg/L
联二酮的含量是啤酒成熟的标志,随着主酵期和后酵期的缩短,双乙酰含量的测定越来越重要。
一、紫外分光光度比色法
1原理
双乙酰作为挥发性组份从啤酒样中蒸发出来,与邻苯二胺反应,生成2,3-二甲喹喔啉,在335nm波长下进行测定。由于其他联二酮类都具有相同的反应特性,再加上蒸馏过程中部分前驱体要转化成联二酮,因此上述测定结果为总联二酮含量(以双乙酰表示)。
2 仪器
带有加热套管的双乙酰
蒸馏器 ;
具有锥形瓶(或平底蒸馏烧瓶)的蒸汽发生瓶:2000mL(或3000mL) ;
容量瓶:25 mL ;
紫外分光光度计:备有10mm石英比色皿或20mm玻璃比色皿。


3 试剂和溶液
3.1 4mol/L盐酸溶液:按GB/T 601配制;
3.2 l0g/L邻苯二胺溶液:称取邻苯二胺0.100g,溶于4mol/L盐酸溶液中,并定容**10mL,摇匀,放于暗处。此溶液须当天配制与使用;若配制出来的溶液呈红色,应重新更换新试剂;
3.3 有机硅消泡剂(或甘油聚醚) 。
4 分析步骤
4.1 蒸馏
将双乙酰
蒸馏器安装好,加热蒸汽发生瓶,使水**沸。通汽预热后,置25mL容量瓶于冷凝器出口接受馏出液,外加冰浴冷却,加2~4滴消泡剂于100mL量筒中,再注入未经除气的预先冷**5℃左右的酒样100mL,迅速移入已预热的
蒸馏器内,并用少量水冲洗带塞漏斗,盖塞。然后用水封口,进行蒸馏,直**馏出液接近25mL(蒸馏需在3~5min内完成)时取下容量瓶,达到室温用水定容,摇匀。
4.2 显色与测量:
分别吸取馏出液10.0mL于两支干燥的比色管中,并于**支管中加入邻苯二胺溶液0.50mL,第二支管中不加(做空白),充分摇匀后,同时置于暗处放置20~30min,然后于**支管中加4mol/L盐酸溶液2mL,于第二支管中加入4mol/L盐酸溶液2.5mL,混匀后,于335nm波长下,用20mm玻璃比色皿,以空白调仪器零点,测定其吸光度。比色测定操作须在20min内完成。
5分析结果的表述
试样中双乙酰含量按式(2)计算:
X=A335×1.2
式中:X —— 试样中双乙酰的含量,mg/L ;
A
335—— 试样在335nm波长下,用20mm比色皿测得的吸光度;
1.2—— 吸光度与双乙酰含量的换算系数。
二、色谱法:
适用于各种类型啤酒中双乙酰含量的测定,结果表示为mg/L,测定值保留二位小数。
2 原理
试样进入色谱柱时,由于在气液两相中分配系数不同,而使双乙酰、2,3-戊二酮、2,3-己
二酮及其他组分得以完全分离。利用电子捕获检测器捕获低能量电子,而使基流下降产生信号,与标准样对照,根据保留时间定性,利用内标法定量。
双乙酰、2,3-戊二酮统称为联二酮,进入色谱柱前不经过加热处理,测得的是游离联二酮;
于60℃加热90min 后,测得的是包括前驱体转化在内的总联二酮。
3 试剂
3.1 氯化钠
3.2 担体:Chromosorb W (AW-DMS),80/100 目。
3.3 固定液:聚乙二醇-20M(PEG-20M)
3.4 2,3-己二酮
内标储备溶液:称取双乙酰500mg,精确**0.1mg,用水溶解,并定容**100mL。该溶液在冷藏条件下可稳定1-2 个月。
内标使用溶液:吸取内标储备溶液1.00mL,置于100mL 容量瓶中,用水稀释**刻度。该溶液需临用时配置。
3.5 2,3-戊二酮
内标储备溶液:称取2,3-戊二酮500mg,精确**0.1mg,用水溶解,并定容**100mL。该溶液在冷藏条件下可稳定1-2 个月。#p#分页标题#e#
内标使用溶液:吸取内标储备溶液1.00mL,置于100mL 容量瓶中,用水稀释**刻度。该溶液需临用时配置。
3.6 双乙酰
内标储备溶液:称取双乙酰500mg,精确**0.1mg,用水溶解,并定容**100mL。该溶液在冷藏条件下可稳定1-2 个月。
内标使用溶液:吸取内标储备溶液1.00mL,置于100mL 容量瓶中,用水稀释**刻度。该溶液需临用时配置。
4 仪器
4.1 气相色谱仪,配有电子捕获检测器(ECD)
4.2 高精度恒温水浴箱,控温精度±0.1℃
4.3 顶空样品瓶,20mL 玻璃瓶
4.4 与顶空样品瓶配套的密封垫及铝帽
4.5 紧口钳
4.6 微量注样器,50mL
4.7 气密性注射器,5mL
5 试样制备
5.1标准溶液的制备
在顶空取样瓶中装入10ml水和4g氯化钠,加入2,3-戊二酮、2,3-己二酮和双乙酰三种标准使用溶液各10μl,用衬有密封垫的铝压盖卷边密封,用手摇匀50s该溶液所含三种标准物质的浓度各为0.05mg/ml。
若预计扩大线性响应范围联二酮(VDKs)含量0.05mg/ml时,应适当调正标准溶液的浓度(如0.10、0.15、0.20mg/ml),使响应值成线性。
5.2 试样的制备
5.2.1 啤酒样品的游离联二酮(VDKs)
取室温下的啤酒样品缓慢倒入刻度试管中用吸管吸去泡沫及多余的酒液**10ml。
于20ml顶空取样瓶中,移入啤酒样10ml,加4g氯化钠和内标(2,3-己二酮)使用溶液10μl,用铝压盖密封,用手摇匀50s。
5.2.2 啤酒样品的总联二酮(VDKs+前驱体)
在400ml烧杯中,取啤酒样100ml轻轻摇动脱气,然后通过两个杯子缓慢注流倒杯5次,使其很好曝气。缓缓倒入刻度试管中,用吸管吸取泡沫及多余的酒液,使试管中的酒样为10ml将其移入装有4g氯化钠的20ml顶空取样瓶中,加入内标(2,3-己二酮)使用溶液10μl,用铝压盖密封。
于60℃水浴中保温90min。冷却**室温后,轻轻拍打瓶盖使盖残留的液滴落下用手摇匀50s。
6.测定
6.1 标准溶液的测定
将按5.1制备的标准溶液放入30℃水浴中保温30min,使气相达到平衡状态。用气密性注射器进样1.0mL,在选择好的色谱条件下进行分析,记录内标、双乙酰和2,3-戊二酮峰的保留时间和峰面积,以峰的保留时间定性,根据峰面积,以三次分析平均值求得相对校正因子f 值。
6.2 试样的测定
将按5.2.2 制备的样品放入30℃水浴中保温30min,使气相达到平衡状态。置于自动进样器上进样1.0ml(或将气体注射器插入试样瓶或标样瓶的瓶颈空气中,反复抽吸5次“冲洗”注射器,然后抽取1.0ml注入色谱仪中),在选择好的色谱条件下进行分析。
注:在色谱仪器分析期间,应将注射器针管拆开,置于40℃的恒温干燥箱中。
7 分析结果的表述
7.1 双乙酰或戊二酮的校正系数按式计算:
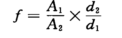
式中f—双乙酰(或2,3-戊二酮)的校正因子
A
1—内标的峰面积
A
2—双乙酰或戊二酮的峰面积
d
1—内标的密度
d
2—双乙酰或戊二酮的密度
7.2 试样中的双乙酰或戊二酮按式计算:
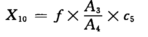
式中X
10—试样中双乙酰或戊二酮的含量,单位为毫克每升(ml/L)
f—双乙酰(或2,3-戊二酮)的校正因子
A
3—试样中双乙酰或2,3-戊二酮的峰面积
A
4—添加于试样中内标的峰面积
C
5—添加于试样中内标的浓度,单位为毫克每升(ml/L)
所得结果表示**二位小数
精密度
重复性条件下获得的两次独立测定结果的**值不得超过算数平均值的10%
啤酒酒精度、真正浓度和原麦汁浓度的测定
啤酒是以大麦芽(包括特种麦芽)为主要原料,加酒花,经酵母发酵酿制而成的、含二氧化碳的、起泡的、低酒精度(2.5-7.5%)的各类熟鲜啤。
啤酒中的“度”是原麦汁浓度,它的测定方法如下:
1.原理
密度瓶法测定溶液的相对密度是在一定温度下,用同一容积的密度瓶分别称取等体积的样品溶液与蒸馏水的质量,从两者的质量比求出试样溶液的相对密度啤酒的酒精度和真正浓度,指啤酒中所含的浸出物的质量分数(不包括乙醇和二氧化碳),都是利用密度瓶测定溶液的相对密度后,查相对密度与乙醇浓度对照表和相对密度与浸出物含量对照表获得的。啤酒的原麦汁浓度是指经糖化灭菌后,进入前发酵之前的麦汁浓度,作为啤酒质量控制的指标和工艺控制的参数而被测定,对实际生产有重要意义。原麦汁浓度不能直接测定得到,而要在测得啤酒的酒精度和真正浓度后计算获得。经研究指出,在发酵完全的情况下,麦汁浸出物的数量与其发酵生成的乙醇和二氧化碳的数量之间有如下关系:
浸出物——→酒精 + CO
2 + 酵母
2.0665g 1g 0.9565g 0.11g
2.0665*A A 1.0665*A
即2.0665的浸出物可生成1g乙醇、0.9565g二氧化碳和0.11g酵母。因此,在测得啤酒的酒精度和真正质量分数后,可按公式计算啤酒的原麦汁浓度。
(二) 试剂
(1)95%的乙醇#p#分页标题#e#
(2)乙醚。
(三)仪器
(1)蒸馏装置
(2)附温密度瓶:容积25.00mL,**呈毛细管状,具有磨口帽。温度**高刻度为40℃,分度值为0.2℃。
(3)低温恒温水浴锅。
(4)分析天平。
(四)操作
1.附温密度瓶的使用
(1)先分别用铬酸洗液和水彻底洗净25.00mL的附温密度瓶,然后再用乙醇和乙醚顺次洗涤数次,吹干后准确称其质量,记为m
0。
(2)用煮沸30min并冷却**15℃的蒸馏水注满附温密度瓶,装上温度计(瓶中应无气泡),浸入20℃+0.1)的恒温水浴中,**附温密度瓶温度计达20℃并保持20~30min不变后,取出,用滤纸吸去溢出侧管的水,立即盖上罩放置,**附温密度瓶的温度升到室温后,擦干,准称其质量,记为m
1。
(3)倒出密度瓶中的水,先用约10mL待测液体洗涤2~3次,再用待测液体注满附温密度瓶,浸入(20+0.1)℃的恒温水浴中,同(2)中方法进行了恒温操作,**后准确称量,记为m
2。
2.酒精的蒸馏
(1)在已称量精确**0.05g的500mL烧瓶中,称取100.00g除气啤酒。
(2)再加入约50mL的蒸馏水,并将蒸馏装置安装好。
(3)在已称精确**0.05g的100mL容量瓶内,加入5mL蒸馏水。将冷凝器出口一端插入容量瓶内,容量瓶用冰浴冷却
(4)加热烧瓶,蒸出酒精,当馏出液质量为100mL时停止蒸馏。
(5)擦干容量瓶后,称量,使馏出液质量为(100+0.1)g。
(6)将馏出液混合均匀后,用附温密度瓶测定馏出液在20℃时的相对密度,并查相对密度与乙醇浓度对照表,求出啤酒样品中酒精的质量分数(%),取两小数。
3.真正质量分数的测定
待500mL烧瓶内的蒸馏残液冷却后,用蒸馏水复重**内容物为100.0g,混合均匀,在20℃下测定液体的相对密度并查相对密度与浸出物含量对照表,求出啤酒样品的真正质量分数(%),保留两位小数。
(五)结果计算
(1)根据测得的密度瓶的质量,按下式求出啤酒样品在℃下的相对密度:
d
2020 = (m
2 – m
0)/(m
1 - m
0)
式中 m
0——空附温密度瓶的质量,g
m
1——附温密度瓶和蒸馏水的总质量,g
m
2——附温密度瓶和试样的总质量,g
(2)根据啤酒的酒精度和真正浓度,按下式计算啤酒的原麦汁浓度:
P(%)= (A * 2.0665 + n)/(100+1.0665 + A)
式中 A——啤酒的酒精度,%
n——真正浓度,%
(六)说明
(1)啤酒中的酒精含量较少,因此用酒精密度计测量时误差较大,一般采用密度瓶法。为了使测定结果正确,要采用蒸馏方法,shou先使酒精和其他可溶性成分分离。
(2)真正浓度的测定是除去啤酒中的乙醇和二氧化碳后,测定其相对密度,一般可以用测定乙醇的残留液进行测定。
(3)水和样品溶液必须装满附温密度瓶,瓶内不得有气泡。
(4)水浴中的水必须清洁无油污。
啤酒苦味质的测定
1.原理
啤酒中苦味物质主要成分是异α—酸,苦味质的测定采用分光光度法,即酸化了的啤酒用异辛烷萃取其苦味物质,以紫外分光光度计,在275nm 波长下用1cm 的比色皿测定其吸光度,用以测定其相对含量。
二、仪器
(1) 离心管:50ml 带聚丙烯旋盖
(2) 低速离心机:**高转速5000 转/ 分钟
(3) 电动振荡机:振荡次数275 次/ 分钟
(4) 紫外—可见分光光度计:配有1cm石英比色皿
(5) 移液管
三、试剂和溶液
(1) 盐酸:6mol/ L
(2) 辛醇:色谱纯
(3) 异辛烷:色谱纯在1cm 比色皿中,以275nm 波长测定其吸光底低于0.005 或接近重蒸馏水的吸光度。在20ml 异辛烷中加一滴辛醇,用1cm 比色皿,在275nm 波长下测其吸光度低于0.005 或接近重蒸馏水的吸光度。
四、实验
用**带有一滴辛醇的移液管,吸取为除气的冷啤酒酒样(10℃)10.0mL于50mL离心管中,加1mL盐酸和20mL异辛烷,旋紧盖,置于电动振荡器上振摇15min(应呈乳状),然后移到离心机上离心10min,使其分层。尽快吸出上层液(异辛烷层),用10mm比色皿,在波长275nm下,以异辛烷作参比液,测定器吸光度值。
吸取10.00ml 已除气温度在20 ±1 ℃啤酒(不能损失泡沫) **50ml离心管中,并加入6mol/ L 的盐酸溶液0.5ml 和20ml 异辛烷,再加入2—3 个玻璃球,拧上带有聚丙烯塞的盖。在电动振荡机上振荡15min (应呈乳状) ,然后移到离心机上以3000 转/ 分离心15min ,使其分层。取离心后的上层清液,置于1cm 石英比色皿中,在波长为处,以空白,测其吸光度。则啤酒中苦味物质的含量为
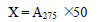
X—试样中苦味质的含量,以“BU”单位表示
A#p#分页标题#e#
275—在275nm 波长下,测得试样的吸光度
50—换算系数
葡萄酒、啤酒中还原糖的测定
直接滴定法
1.原理
利用费林溶液与还原糖共沸,生成氧化亚铜沉淀的反应,以次甲基蓝为指示液,以样品或经水解后的样品滴定煮沸的费林溶液,达到终点时,稍微过量的还原糖将蓝色的次甲基蓝还原为无色,以示终点。根据样品消耗量求得总糖或还原糖的含量。
2.试剂和材料
(1)盐酸溶液(1+1)。
(2)氢氧化钠溶液:200 g/L。
(3)标准葡萄糖溶液 2.5 g/L:精确称取 2.5g(称准**0.0001g)在105~110℃烘箱内烘干3h并在干燥器中冷却的葡萄糖,用水溶解并定容**1 000 mL。
(4)次甲基蓝指示液 10g/L:称取 1.0 g次甲基蓝,溶解于水中,稀释** 100mL。
(5) 费林溶液
a) 配制:
溶液Ⅰ: 称取34.7 g硫酸铜(CuSO
4·5H
20),溶于水,稀释**500mL;
溶液Ⅱ。 称取173g酒石酸钾钠(C
4H
4KNaO
6·4H
2O)和50g氢氧化钠,溶于水,稀释**500mL。
使用时将溶液Ⅰ与溶液Ⅱ按同体积混合。
b) 标定预备试验:吸取费林溶液Ⅰ、Ⅱ 各 5.00mL于 250mL三角瓶中,加 50mL水,摇匀,在电炉上加热**沸,在沸腾状态下用制备好的葡萄糖标准溶液滴定,当溶液的蓝色将消失呈红色时,加2滴次甲基蓝指示液,继续滴**蓝色消失,记录消耗的葡萄糖标准溶液的体积。
c) 正式试验:吸取费林溶液Ⅰ、Ⅱ各 5.00 mL于 250mL三角瓶中,加50mL水和比预备试验少1mL的葡萄糖标准溶液,加热**沸,并保持2min,加2滴次甲基蓝指示液,在沸腾状态下于1min内用葡萄糖标准溶液滴**终点,记录消耗的葡萄糖标准溶液的总体积。
d)计算
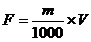
式中: F——费林溶液Ⅰ、Ⅱ各 5 mL相当于葡萄糖的克数,g;
m——称取葡萄糖的质量,g;
V——消耗葡萄糖标准溶液的总体积,mL。
3.试样的制备
准确吸取一定量的样品(V
1)于100 mL容量瓶中,使之所含还原糖量为0.2~0.4g,加水定容**刻度。
4.分析步骤
以试样代替葡萄糖标准溶液,按2.b同样操作,记录消耗试样的体积(V
3),结果按(1)式计算。
测定干葡萄酒样品按2.b操作时,正式滴定需用葡萄糖标准溶液滴定**终点。结果按(2)式计算。
5.结果计算
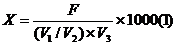
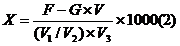
式中:X——总糖或还原糖的含量,g/L;
F——费林溶液Ⅰ、Ⅱ各 5 mL相当于葡萄糖的克数,g;
V
1——吸取的样品体积,mL;
V
2——样品稀释后或水解定容的体积,mL;
V
3——消耗试样的体积,mL;
G——葡萄糖标准溶液的准确浓度,g/mL;
V——消耗葡萄糖标准溶液的体积,mL。
所得结果应表示**一位小数。
6.精密度
在重复性条件下获得的两次独立测定结果的**差值不得超过算术平均值的2% 。
葡萄酒中二氧化硫和色素的测定
1.葡萄酒中二氧化硫的测定
快速测定法
1.原理
经过准确称量的食品试样,其中的亚硫酸盐与四氯汞钠反应生成稳定的化合物,再与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物,根据络合物对可见光有选择性的吸收,可在仪器上测量出被测样品中二氧化硫的含量。
2.试剂
二氧化硫试剂(一)的配制:打开二氧化硫试剂(一)(固体)外包装,将试剂全部倒入二氧化硫试剂(一)塑料方瓶中,用少量蒸馏水溶解后稀释**500毫升刻度线,摇匀,放置12小时后备用(如发现有沉淀请过滤后使用)。
二氧化硫试剂(二),白色塑料管;
二氧化硫试剂(三),红色小号塑料管;
二氧化硫试剂(四),红色大号塑料管;
二氧化硫试剂(五),黑色塑料管;
二氧化硫试剂(六),棕色塑料管。
所有二氧化硫试剂均需避光、低温(冰箱4℃左右)保存!!!
3.操作步骤
⑴样品处理 。
准确移取质量为1.00克液体样品,置于10毫升比色瓶中,用移液器准确加入2.00毫升二氧化硫试剂(一),用水稀释**10毫升,用摇匀后备用(若溶液不澄清,可用针头式过滤器过滤后使用,过滤方法与固体样品相同)。
针头式过滤器使用方法: 将塑料连接管安装在注射器针头位置,吸取待过滤溶液约5毫升,取下塑料连接管,安装上针头式过滤器(预先在过滤器上安好滤膜,滤膜一次性使用,过滤器洗净后看重复使用),将待测溶液过滤于一支干净并且干燥过的比色瓶中备用。
⑵二氧化硫的测定
①样品:用1.0毫升移液管准确吸取待测溶液0.50或0.10毫升置于干燥过的比色瓶(样品)中,用长颈塑料滴管移取二氧化硫试剂(一)稀释**10毫升刻度线。再加入二氧化硫试剂(二)0.2mL、(三)0.2mL、(四)0.4mL后摇匀,静置显色20分钟后测定。
②试剂空白:用长颈塑料滴管移取二氧化硫试剂(一)置于干燥过的比色瓶2的10毫升刻度线。再加入二氧化硫试剂(二)0.2mL、(三)0.2mL、(四)0.4mL后摇匀,静止显色20分钟后测定(样品与试剂空白同时操作)。旋紧比色瓶定位器,擦净比色瓶外壁,将蓝色刻度线比seo平(空白)放入比色槽中锁定。#p#分页标题#e#
③仪器显示说明
表示仪器处于准备状态,可正常工作。
表示仪器已调零完毕。
表示被测样品浓度。
当显示屏末位出现“c”闪动时,表示被测样品浓度超过仪器测量范围, 需重新取样稀释后测量。
表示电压不足,应立即更换电池。
④测定步骤
a.旋紧比色瓶2定位器,擦净比色瓶外壁, 将试剂空白比色瓶2放入比色瓶槽中锁定。
b.按“开/关”键,打开仪器,当仪器液晶屏上出现“――――” 后,按“调零”键,出现“0.00”(空白调零已完成)。
c.取出试剂空白比色瓶2,旋紧比色瓶1定位器,擦净样品比色瓶1外壁,将样品比色瓶放入比色瓶槽中,锁定比色瓶,按“浓度” 键,显示屏上出现的数值即为样品溶液的浓度值。
4.结果计算
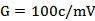

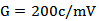

5.结果判断
⑴当样品比色瓶中溶液颜色为粉红色时,表明被测样品中可能含有二氧化硫。颜色越深,说明样品中二氧化硫含量越高。
⑵根据仪器所测结果,与G标限量标准进行比较,判断出样品中二氧化硫是否超标。
G标法
原理
啤酒中以气态和水合态形式存在的游离二氧化硫与以亚硫酸盐形式存在的结合态二氧化硫的总和即为总二氧化硫亚硫酸盐与四氯汞钠反应生成稳定的络合物再与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物与标准系列比色定量
仪器:分光光度计 恒温水浴, 控温精度 0.1℃ 感量为0.1mg 的分析天平
试剂和溶液:碘化钾 重铬酸钾 盐酸溶液1+1 硫酸溶液0.1mol/L 硫酸溶液1+4 氢氧化钠溶液0.1mol/L 碘溶液0.1mol/L 碘溶液0.05mol/L 汞稳定剂溶液 硫代硫酸钠标准溶液0.1mol/L 二氧化硫储备液5mg/mL 二氧化硫标准使用液50mg/mL 盐酸副玫瑰苯胺溶液0.4g/L 淀粉指示剂溶液10g/L 冰乙酸r约1.049 g/mL 甲醛 己醇消泡剂
操作步骤和要点:
1.样品的制备
吸取 2mL 汞稳定剂溶液及5mL 硫酸溶液0.1mol/L 于100mL 容量瓶中用加有1 滴正己醇消泡剂的量筒仔细量取10mL 冷的未脱气啤酒**容量瓶中旋转混合加入15mL氢氧化钠溶液0.1mol/L 旋转混合并保持15 秒再加入10mL 硫酸溶液0.1mol/L 加水**刻度混匀吸取25mL 上述溶液于50mL 容量瓶中
2.样品空白的制备
用加有 1 滴正己醇消泡剂的量筒仔细量取10mL 冷的未脱气的啤酒**100mL 容量瓶中加入0.5mL 淀粉指示剂溶液10g/L 然后用滴管小心滴加碘溶液0.1mol/L **蓝色
不褪再加入1 滴碘溶液0.1mol/L 使碘稍过量加水**刻度充分混匀当蓝色稍淡一些后吸取25mL 上述溶液于50mL 容量瓶中
3.测定
⑴标准曲线的制作
①二氧化硫标准系列溶液的配制
用加有 1 滴正己醇消泡剂的10mL 量筒分别量取6 份10mL 冷的未脱气的啤酒**6个100mL 容量瓶中依次加入0 0.5 1.0 2.0 3.0 5.0mL 二氧化硫标准使用液50mg/mL相应的二氧化硫含量为0 25 50 100 150 250mg 用水定容混匀分别吸取25mL 上述溶液于50mL 容量瓶中
②标准曲线的测定
在上述 6 个25mL 溶液中加入5mL 盐酸副玫瑰苯胺溶液0.4g/L 旋转混合再加入5mL 甲醛溶液5 995 用水稀释**刻度混匀于25 水浴保温30 分钟取出后用1cm吸收皿以未加标样的显色液作参比在分光光度计上于波长550nm 处测定吸光值制作标准曲线的线性回归方程
⑵样品的测定
以样品空白作参比按标准溶液操作,测定样品的吸光度二氧化硫含量,通过校准曲线线性回归方程计算求得
⑶数据记录
3.结果计算
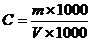
式中
C 样品中二氧化硫的含量mg/L
m 测定用样液中二氧化硫的含量 μg
V 测定用样品的体积 mL
2.葡萄酒中色素含量的测定
检测对象:红色素、黄色素、亮蓝、靛蓝
检 出 限:10mg/kg
检测范围:0–150mg/kg
波长准确度:< 2nm
一、功能控制及控制面板
1、[0,1,…,9,.]:输入数字键
2、[功能键]
· [ESC]: 回到前一菜单界面;
· [PRINT]: 打印;
· [ABS %T]: 输入参数;
· [← / → / ↑ / ↓]: 上下左右移动光标;
· [ZERO]: 测定空白溶液;#p#分页标题#e#
· [ENTER]: 测定样品或选择确认
* [PRINT] 功能始终在激活状态。
二、仪器基本操作流程
1、【打开开关】
打开仪器电源后仪器进行自检及初始化。自检及初始化的时间需要20~30秒。自检及初始化完成之后,仪器需要约10分钟的预热时间。
2、【主菜单】
自检及初始化结束后,仪器自动进入主菜单
3、【选择测定模块】
在主菜单中输入要测定项目编号(编号请参考实验步骤)进入参数界面如[,输入参数(参数值请参考实验步骤)后按确认键[ENTER]进入测定界面如,进入测定界面过程需10秒左右。
4、【进行测定】
进入测定界面后池架内放进空白溶液样品,按[ZERO]键进行空白溶液测定。空白测定界面如[图5],此过程需1~2分钟。
空白溶液测定完成后屏幕显示样品测定界面。取出池架中的空白溶液,再放进样品溶液按[ENTER]进行样品测定测定如,此过程需1~2分钟。
5、【测定结果】
样品测定完成后显示测定结果。
如需打印按[PRINT]键,返回上一界面按[ESC],继续测定按[ENTER]键。
6、【关闭仪器】
所有检测实验结束后,须关闭电源。
三、检测流程
① 称取5 g(克)样品置于样品处理瓶,加<色素检测试剂1>和<色素检测试剂2>各1ml(毫升),再加5ml蒸馏水摇匀,过滤后备用。
② 取2ml过滤液置于干净比色杯,即为样品溶液。
③ 取5ml过滤液置于样品处理瓶,加0.5g<色素检测试剂3>搅拌均匀后再过滤。
④ 上述过滤液中取2ml(毫升)置于干净比色杯,即为空白溶液。
⑤ 空白溶液放入仪器,按照仪器操作说明步骤进行空白溶液测定。
⑥ 样品溶液放入仪器,按照仪器操作说明步骤进行样品溶液测定。
葡萄酒中铁含量的测定
原子吸收分光光度法
4.9.1.1 原理
将处理后的试样导入原子吸收分光光度计中,在乙炔 空气火焰中,试样中的铁被原子化,基态原子铁吸收特征波长(248.3 nm)的光,吸收量的大小与试样中铁原子浓度成正比,测其吸光度,求得铁含量。
4.9.1.2 试剂和材料
本试验中所用水应符合GB 6682中二级水规格,所用试剂为优级纯(GR)。
4.9.1.2.1 硝酸溶液(0.5%):量取 5 mL硝酸,稀释** 1 000 mL。
4.9.1.2.2 铁标准贮备液(0.1 mg/mL):按GB/T 602配制。
4.9.1.2.3 铁标准使用液(1 mL溶液含 10 μg铁):吸取 10.00 mL铁标准贮备液于 100 mL容量瓶中,用0.5%硝酸溶液稀释**刻度,此溶液每毫升含10 μg铁。
4.9.1.2.4 铁标准系列:吸取铁标准使用液 0.00,1.00,2.00,4.00,5.00 mL(含 0.0,10.0,20.0.40.0,50.0 μg铁)分别于五个 100 mL容量瓶中,用 0.5%硝酸溶液稀释**刻度,混匀。该系列用于标准工作曲线的绘制。
4.9.1.3 仪器
原子吸收分光光度计:备有铁空心阴极灯。
4.9.1.4 试样的制备
用0.5%硝酸准确稀释样品**5~10倍,摇匀,备用。
4.9.1.5 分析步骤
4.9.1.5.1 标准工作曲线的绘制:置仪器于合适的工作状态,调波长** 248.3 nm,导入标准系列溶液,以零管调零,分别测定其吸光度。以铁的含量对应吸光度绘制标准工作曲线(或者建立回归方程)。
4.9.1.5.2 试样的测定:将试样导入仪器,测其吸光度,然后根据吸光度在标准曲线上查得铁的含量(或带入回归方程计算)。
4.9.1.6 结果计算

式中:X——样品中铁的含量, mg/L;
A——试样中铁的含量,mg/L;
F——样品稀释倍数。
所得结果应表示**一位小数。
4.9.1.7精密度
在重复性条件下获得的两次独立测定结果的**差值不得超过算术平均值的10% 。
4.9.2邻菲啰啉比色法
4.9.2.1 原理
样品经处理后,试样中的三价铁在酸性条件下被盐酸羟胺还原成二价铁,与邻菲啰啉作用生成红色螯合物,其颜色的深度与铁含量成正比,用分光光度法进行铁的测定。
4.9.2.2 试剂和材料
4.9.2.2.1 浓硫酸;
4.9.2.2.2 过氧化氢溶液30%。
4.9.2.2.3 氨水 25%~28%。
4.9.2.2.4 盐酸羟胺溶液(100 g/L):称取 100 g盐酸羟胺,用水溶解并稀释**1000 mL,于棕色瓶中低温贮存。
4.9.2.2.5 盐酸溶液(1+1)。
4.9.2.2.6 乙酸 乙酸钠溶液(pH=4.8):称取 272 g乙酸钠(CH3COONa•3H2O),溶解于 500 mL 水中,加 200 mL冰乙酸,加水稀释** 1 000 mL。
4.9.2.2.7 1,10-菲啰啉溶液(2 g/L):按 GB/T 603配制。
4.9.2.2.8 铁标准贮备液(1 mL溶液含有0.1 mg铁):同4.9.1.2.2。
4.9.2.2.9 铁标准使用液(1 mL溶液含 10 μg铁):同 4.9.1.2.3。
4.9.2.2.10 铁标准系列:吸取铁标准使用液 0.00,0.20,0.40,0.80,1.00,1.40 mL(含 0.0,2.0,4.0,8.0,10.0,14.0 μg铁)分别于六支 25 mL比色管中,补加水** 10 mL,加 5 mL乙酸 乙酸钠溶液(调pH** 3~5)、1 mL盐酸羟胺溶液,摇匀,放置5 min后,再加入1 mL 1,10-菲啰啉溶液,然后补加水**刻度,摇匀,放置 30 min,备用。该系列用于标准工作曲线的绘制。#p#分页标题#e#
4.9.2.3 仪器
4.9.2.3.1 分光光度计。
4.9.2.3.2 高温电炉:(550±25)℃。
4.9.2.3.3 瓷蒸发皿:100 mL。
4.9.2.4 试样的制备
4.9.2.4.1 干法消化:准确吸取 25.00 mL样品(V)于蒸发皿中,在水浴上蒸干,置于电炉上小心炭化,然后移入 (550±25)℃高温电炉中灼烧,灰化**残渣呈白色,取出,加入 10 mL盐酸溶液溶解,在水浴上蒸**约 2 mL,再加入 5 mL水,加热煮沸后,移入 50 mL容量瓶中,用水洗涤蒸发皿,洗液并入容量瓶,加水稀释**刻度(V1),摇匀。同时做空白试验。
4.9.2.4.2 湿法消化:准确吸取 1.00 mL样品(V)(视含铁量增减)于 10 mL凯氏烧瓶中,置电炉上缓缓蒸发**近干,取下稍冷后,加1 mL浓硫酸(根据含糖量增减)、1 mL过氧化氢,于通风厨内加热消化。
如果消化液颜色较深,继续滴加过氧化氢溶液,直**消化液无色透明。稍冷,加10 mL水微火煮沸 (3~5) min,取下冷却。同时做空白试验。
注1:磺基水杨酸测铁,化学法测铜时,此取样量为 5 mL。
注2:各实验室可根据各自条件选用干法或湿法进行样品的消化。
4.9.2.5 分析步骤
4.9.2.5.1 标准工作曲线的绘制
在 480 nm波长下,测定标准系列(4.9.2.2.10)的吸光度。根据吸光度及相对应的铁浓度绘制标准工作曲线(或建立回归方程)。
4.9.2.5.2 试样的测定
准确吸取 4.9.2.4.1中试样消化液 5~10 mL(V1)及试剂空白消化液分别于25 mL比色管中,补加水** 10 mL,然后按标准工作曲线的绘制同样操作,分别测其吸光度,从标准工作曲线上查出铁的含量(或用回归方程计算)。
或将4.9.2.4.2中的试样及空白消化液洗入25 mL比色管中,在每支管中加入一小片刚果红试纸,用氨水中和**试纸显蓝紫色,然后各加5 mL乙酸 乙酸钠溶液(调 pH**3~5),以下操作同标准工作曲线的绘制。以测出的吸光度,从标准工作曲线上查出铁的含量(或用回归方程计算)。 用回归方程计算)。 4.9.2.6 结果计算
4.9.2.6.1 干法计算
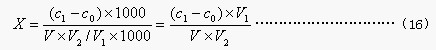
式中:X——样品中铁的含量,mg/L;
c1——测定用样品中铁的含量,μg;
c0——试剂空白液中铁的含量,μg;
V——取样体积,mL;
V1——样品消化液的总体积,mL;
V2——测定用试样的体积,mL。
4.9.2.6.2 湿法计算

式中:X——样品中铁的含量,mg/L;
A——测定用样品中铁的含量,μg;
A0——试剂空白液中铁的含量,μg;
V——取样体积,mL。
所得结果应表示**一位小数。
4.9.2.6.3精密度
在重复性条件下获得的两次独立测定结果的**差值不得超过算术平均值的10% 。
4.9.3磺基水杨酸比色法
4.9.3.1 原理
样品经处理后,样液中的三价铁离子在碱性氨溶液中(pH=8~10.5)与磺基水杨酸反应生成黄色络合物,可根据颜色的深浅进行比色测定。
4.9.3.2 试剂和材料
4.9.3.2.1 磺基水杨酸溶液 100 g/L。
4.9.3.2.2 氨水(1+1.5)。
4.9.3.2.3 铁标准贮备液(1 mL溶液含有 0.1 mg铁):同 4.9.2.2.8。
4.9.3.2.4 铁标准使用液(1 mL溶液含有10 μg铁):同 4.9.2.2.9。
4.9.3.2.5 铁标准系列:吸取铁标准使用液 0.00,0.50,1.00,1.50,2.00,2.50 mL(含0.0,5,0,10.0,15.0,20.0,25.0 μg铁)分别于六支 25 mL比色管中,分别加入 5 mL磺基水杨酸溶液,用氨水中和**溶液呈黄色时,再加 0.5 mL后,以水稀释**刻度,摇匀。
4.9.3.3 仪器
同4.9.2.3。
4.9.3.4 试样的制备
同 4.9.2.4。
4.9.3.5 分析步骤
吸取干法试样5.00 mL(可根据铁含量,适当增减)和同量空白消化液分别于 25 mL比色管中,或者将湿法试样及空白消化液洗入 25 mL比色管中,然后按 4.8.16.5条同样操作,将其与标准系列进行目视比色,记下与样液颜色深浅相同的标准管中铁的含量。
4.9.3.6 结果计算
同 4.9.2.6。
所得结果应表示**整数。
4.9.3.7精密度
在重复性条件下获得的两次独立测定结果的**差值不得超过算术平均值的10% 。
葡萄酒中柠檬酸含量的测定
原理
同一时刻进入色谱柱的各组分,由于在流动相和固定相之间溶解、吸附、渗透或离子交换等作用的不同,随流动相在色谱柱两相之间进行反复多次的分配,由于各组分在色谱柱中的移动速度不同,经过一定长度的色谱柱后,彼此分离开来,按顺序流出色谱柱,进入信号检测器,在记录仪上或数据处理装置上显示出各组分的谱峰数值,根据保留时间用归一化法或外标法定量。
4.6.2试剂和材料
4.6.2.1 磷酸
4.6.2.2 NaOH溶液:0.01mol/L,称取0.04g NaOH于100mL容量瓶中,加水溶解定容。。#p#分页标题#e#
4.6.2.3 KH2PO4水溶液:0.02mol/L,用磷酸调pH 2.9,经0.45µm微孔滤膜过滤。
4.6.2.4 无水柠檬酸 (AR 级)
4.6.2.5 柠檬酸储备溶液:称取无水柠檬酸0.05g,精确**0.0001g,用0.01mol/L 的NaOH溶解后定容**50mL,此溶液含柠檬酸1g/L。
4.6.2.6 柠檬酸标准系列溶液:将柠檬酸储备溶液用0.01mol/LNaOH稀释分别成浓度为0.05、0.10、0.20、0.40、0.80g/L、1.20g/L、1.60g/L、2.00g/L的标准系列溶液。
4.6.3 仪器
4.6.3.1 高效液相色谱系统:配有紫外检测器和色谱柱恒温箱。
4.6.3.2 色谱分离柱: Hypersil ODS2,柱尺寸:φ5.0mm×200mm,填料粒径:5μm 或其他分析效果类似的色谱柱。
4.6.3.3 微量注射器:10μL。
4.6.3.4 流动相真空抽滤脱气装置及0.2μm或0.45μm微孔膜;
4.6.3.5分析天平,感量0.0001g。
4.6.4 分析步骤
4.6.4.1 试样的制备
吸取10mL酒样于100mL容量瓶中,加水定容,经0.45µm微孔滤膜过滤后,备用。
4.6.4.2 样品测定:
4.6.4.2.1 色谱条件
柱温:室温
流动相:0.02mol/L KH2PO4溶液,pH 2.9(5.6.2.3)
流速:0.5mL/min
检测波长:214nm
进样量:10μL。
4.6.4.2.2 标准曲线
将柠檬酸标准系列溶液(4.6.2.6)分别进样后,以标样浓度对峰面积作标准曲线。线性相关系数应为0.9990以上。
4.6.4.2.3 将4.6.4.1制备好的试样进样。根据标准品的保留时间定性样品中柠檬酸的色谱峰。根据样品的峰面积,查标准曲线得出柠檬酸含量。
4.6.5 结果计算

式中: Xi——样品中柠檬酸的含量,g/L;
Ci——从标准曲线求得测定溶液中柠檬酸的含量,g/L;
F——样品的稀释倍数。
计算结果保留一位小数。
4.6.6精密度
在重复性条件下获得的两次独立测定结果的**差值不得超过算术平均值的5% 。
啤酒中蛋白质的测定
原理:
食品中的蛋白质在催化加热条件下被分解,产生的氨与硫酸结合生成硫酸铵。碱化蒸馏使氨游离,
用硼酸吸收后以硫酸或盐酸标准滴定溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质的含量。
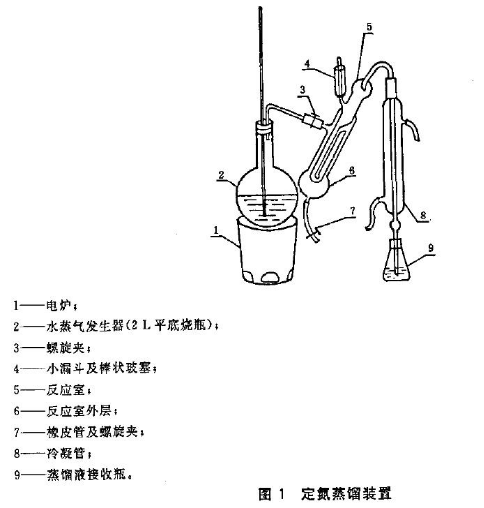
仪器:天平:感量为 1mg 定氮蒸馏装置
试剂和溶液:硫酸铜 硫酸钾 硫酸 2%硼酸溶液 甲基红﹣溴甲酚绿混合指示液 40%氢氧化钠溶液 0.05mol/L 盐酸标准溶液 亚甲基蓝指示剂 95%乙醇 硼酸溶液(20 g/L)氢氧化钠溶液(400 g/L)盐酸标准滴定溶液(0.0500 mol/L) 甲基红乙醇溶液(1 g/L) 溴甲酚绿乙醇溶液(1 g/L) 混合指示液: 1 份甲基红乙醇溶液与 5 份溴甲酚绿乙醇溶液临用时混合
操作步骤和要点:
1.试样处理
精密吸取10~20ml液体样品(约相当氮30~40mg),移入干燥的100ml或500ml定氮瓶中,加入0.2g硫酸铜,3g硫酸钾及20ml硫酸,稍摇匀后于瓶口放一小漏斗,将瓶以45°角斜支于有小孔的石棉网上。小心加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,**液体呈蓝绿色澄清透明后,再继续加热0.5h。取下放冷,小心加20ml水。放冷后,移入100ml容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水**刻度,混匀备用。取与处理样品相同量的硫酸铜、硫酸钾、硫酸按同一方法做试剂空白试验。
2.测定
按图装好定氮装置,于水蒸气发生瓶内装水**约2/3处,加甲基红指示液数滴及数毫升硫酸,以保持水呈酸性,加入数粒玻璃珠以防暴沸,用调压器控制,加热煮沸水蒸气发生瓶内的水。向接收瓶内加入10ml 2%硼酸溶液及混合指示液1滴,并使冷凝管的下端插入液面下,吸取10.0ml样品消化稀释液由小玻杯流入反应室,并以10ml水洗涤小烧杯使流入反应室内,塞紧小玻杯的棒状玻塞。将10ml 40g/L氢氧化钠溶液倒入小玻杯,提起玻塞使其缓缓流入反应室,立即将玻塞盖紧,并加水于小玻杯以防漏气。夹紧螺旋夹,开始蒸馏。蒸气通入反应室使氨通过冷凝管而进入接收瓶内,蒸馏5min。移动接受瓶,使冷凝管下端离开液面,再蒸馏1min。然后用少量水冲洗冷凝管下端外部。取下接收瓶,以0.05mol/L盐酸标准溶液滴定**灰色或蓝紫色为终点。
同时吸取10.0ml试剂空白消化液同试样操作。
3.计算
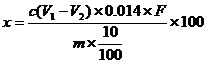
式中:X——样品中蛋白质的含量,%;
V
1——样品消耗硫酸或盐酸标准液的体积,ml;
V
2——试剂空白消耗硫酸或盐酸标准液的体积,ml;
N——硫酸或盐酸标准溶液的当量浓度;
0.014——1N硫酸或盐酸标准溶液1ml相当于氮克数;
m——样品的质量(体积),g(ml);
F——氮换算为蛋白质的系数。


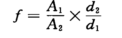
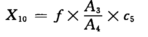
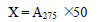
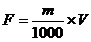
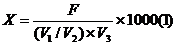
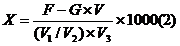
 表示仪器处于准备状态,可正常工作。
表示仪器处于准备状态,可正常工作。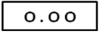 表示仪器已调零完毕。
表示仪器已调零完毕。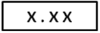 表示被测样品浓度。
表示被测样品浓度。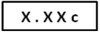 当显示屏末位出现“c”闪动时,表示被测样品浓度超过仪器测量范围, 需重新取样稀释后测量。
当显示屏末位出现“c”闪动时,表示被测样品浓度超过仪器测量范围, 需重新取样稀释后测量。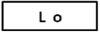 表示电压不足,应立即更换电池。
表示电压不足,应立即更换电池。